摘要
鋰離子電池中極片殘留水分測試及所帶來的影響
內(nèi)容
1����、水分危害電池性能的基本機(jī)理
鋰離子電池中水分如果過高���,會與電解液反應(yīng)����。首先�����,水分與電解液里面的鋰鹽反應(yīng)生成HF:
H2O+LiPF6→POF3+LiF+2HF
氫氟酸是一中腐蝕性很強(qiáng)的酸,它可以使電池內(nèi)部的金屬零件腐蝕�,進(jìn)而使電池最終漏液。而且HF破壞SEI膜��,會與SEI膜主要成分繼續(xù)發(fā)生反應(yīng):
ROCO2Li+HF→ROCO2H+LiF
Li2CO3+2HF→H2CO3+2LiF
最后����,在電池內(nèi)部產(chǎn)生LiF沉淀,使鋰離子在電池負(fù)極片發(fā)生不可逆轉(zhuǎn)的化學(xué)反應(yīng)��,消耗活性鋰離子�����,電池的能量就減少了��。當(dāng)水分足夠多時�,產(chǎn)生的氣體多,電池內(nèi)部的壓力就會變大�����,從而引起電池受力變形,出現(xiàn)電池鼓漲�,漏液等危險。
2�、極片殘留水分測試
電池極片中殘留的水分一般為幾百ppm,相對而言水分含量較低��,無法用簡單方法測量����,一般采用卡爾費(fèi)休庫倫法測試微量水分,其原理是一種電化學(xué)方法����。儀器電解池中的卡氏試劑達(dá)到平衡時注入含水的樣品,水參與碘����、二氧化硫的氧化還原反應(yīng)��,在吡啶和甲醇存在的情況下�,生成氫碘酸吡啶和甲基硫酸吡啶,消耗了的碘在陽極電解產(chǎn)生����,從而使氧化還原反應(yīng)不斷進(jìn)行,直至水分全部耗盡為止��,依據(jù)法拉第電解定律,電解產(chǎn)生的碘同電解時耗用的電量成正比例關(guān)系的����,其反應(yīng)如下:
H2O+I2+SO2+3C5H5N→2C5H5N·HI+C5H5N·SO3
在電解過程中,電極反應(yīng)如下:
陽極:2I--2e→I2
陰極:I2+2e→2I-
2H++2e→H2↑
從以上反應(yīng)中可以看出�����,即1摩爾的碘氧化1摩爾的二氧化硫�����,需要1摩爾的水��。所以電解碘的電量相當(dāng)于電解水的電量�����,電解1摩爾碘需要2×96493庫侖電量�,電解1毫摩爾水需要電量為96493毫庫侖電量。樣品中水分含量根據(jù)式(1)計算:
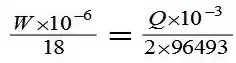
式中:W---樣品中的水分含量����,μg;Q---電解電量,mC�;18---水的分子量。
卡爾費(fèi)休微量水分測試儀一般結(jié)構(gòu)如圖1所示����,主要包含卡爾費(fèi)休電解池和卡氏加熱爐,極片樣品放入密封樣品瓶中��,然后一定溫度下加熱樣品瓶��,樣品中的水分蒸發(fā)��,然后利用干燥氣體將水蒸氣送入電解池中參與反應(yīng)�,再測定電解過程中的電量,從而滴定水分含量��。
相關(guān)資料